EFECTO INVERNADERO
La atmósfera de la Tierra está compuesta de muchos gases. Los más abundantes son el nitrógeno y el oxígeno (este último es el que necesitamos para respirar). El resto, menos de una centésima parte, son gases llamados "de invernadero". No los podemos ver ni oler, pero están allí. Algunos de ellos son el dióxido de carbono, el metano y el dióxido de nitrógeno.
En pequeñas concentraciones, los gases de invernadero son vitales para nuestra supervivencia. Cuando la luz solar llega a la Tierra, un poco de esta energía se refleja en las nubes; el resto atraviesa la atmósfera y llega al suelo. Gracias a esta energía, por ejemplo, las plantas pueden crecer y desarrollarse.
En pequeñas concentraciones, los gases de invernadero son vitales para nuestra supervivencia. Cuando la luz solar llega a la Tierra, un poco de esta energía se refleja en las nubes; el resto atraviesa la atmósfera y llega al suelo. Gracias a esta energía, por ejemplo, las plantas pueden crecer y desarrollarse.
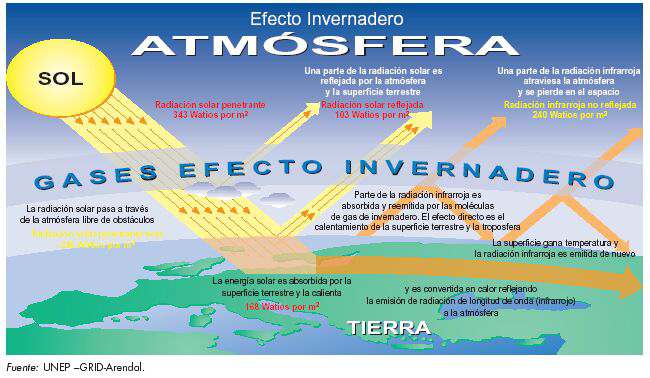
Pero no toda la energía del Sol es aprovechada en la Tierra; una parte es "devuelta" al espacio. Como la Tierra es mucho más fría que el Sol, no puede devolver la energía en forma de luz y calor. Por eso la envía de una manera diferente, llamada "infrarroja". Un ejemplo de energía infrarroja es el calor que emana de una estufa eléctrica antes de que las barras comiencen a ponerse rojas.
Los gases de invernadero absorben esta energía infrarroja como una esponja, calentando tanto la superficie de la Tierra como el aire que la rodea. Si no existieran los gases de invernadero, el planeta sería ¡cerca de 30 grados más frío de lo que es ahora! En esas condiciones, probablemente la vida nunca hubiera podido desarrollarse. Esto es lo que sucede, por ejemplo, en Marte. En el pasado, la Tierra paso diversos periodos glaciales. Hoy día quedan pocas zonas cubiertas de hielo. Pero la temperatura mediana actual es solo 4 ºC superior a la del ultimo periodo glacial, hace 18000 años.Marte tiene casi el mismo tamaño de la Tierra, y está a una distancia del Sol muy similar, pero es tan frío que no existe agua líquida (sólo hay hielo), ni se ha descubierto vida de ningún tipo. Esto es porque su atmósfera es mucho más delgada y casi no tiene gases de invernadero. Por otro lado, Venus tiene una atmósfera muy espesa, compuesta casi en su totalidad por gases de invernadero. ¿El resultado? Su superficie es 500ºC más caliente de lo que sería sin esos gases.
Por lo tanto, es una suerte que nuestro planeta tenga la cantidad apropiada de gases de invernadero.
El efecto de calentamiento que producen los gases se llama efecto invernadero: la energía del Sol queda atrapada por los gases, del mismo modo en que el calor queda atrapado detrás de los vidrios de un invernadero.En el Sol se producen una serie de reacciones nucleares que tienen como consecuencia la emisión de cantidades enormes de energía. Una parte muy pequeña de esta energía llega a la Tierra, y participa en una serie de procesos físicos y químicos esenciales para la vida.
Prácticamente toda la energía que nos llega del Sol está constituida por radiación infrarroja, ultravioleta y luz visible. Mientras que la atmósfera absorbe la radiación infrarroja y ultravioleta, la luz visible llega a la superficie de la Tierra. Una parte muy pequeña de esta energía que nos llega en forma de luz visible es utilizada por las plantas verdes para producir hidratos de carbono, en un proceso químico conocido con el nombre de fotosíntesis. En este proceso, las plantas utilizan anhídrido carbónico y luz para producir hidratos de carbono (nuevos alimentos) y oxígeno. En consecuencia, las plantas verdes juegan un papel fundamental para la vida, ya que no sólo son la base de cualquier cadena alimenticia, al ser generadoras de alimentos sino que, además, constituyen el único aporte de oxígeno a la atmósfera.
Principales fuentes de emisión de CO2 y la contribución de los países industrializados a la emisión de este compuesto
Con el inicio de la Revolución Industrial, la concentración de los gases de efecto invernadero (GEI) de la atmósfera mostró los siguientes incrementos: bióxido de carbono (CO2), 31%; metano (CH4), 151%, y óxidos de nitrógeno (N2O), 17%. Los científicos consideran que estas adiciones son resultado de la quema de los combustibles fósiles y, en menor proporción, de la contribución de otras actividades humanas (IPCC 2001).
La temperatura del planeta aumentó en aproximadamente 0.6ºC durante el siglo XX. Desde 1861, la década más caliente ha sido la de los años noventa, y el año más caluroso fue 1998 (Depledge 2002). Esta tendencia se ha atribuido a la acumulación de CO2 y de otros gases en la atmósfera, derivados de la actividad humana .
EMISIONES HISTÓRICAS POR PAÍS
El total de carbono emitido en el siglo pasado a partir de la quema de combustibles fósiles fue de 261,233 millones de toneladas, en las que 19 países contribuyeron con 82.8% de las emisiones, y el resto del mundo contribuyó con el 17.2%.
México emitió 2,627 millones de toneladas de carbono que corresponden al 1% de las emisiones totales durante el período considerado (1900-2000), ubicándose en la posición número 15, junto con la ahora República Checa y Bélgica cuyas emisiones fueron similares.
GRÁFICA 8. EMISIONES HISTÓRICAS DE CARBONO POR PAÍS, 1900-2000

Fuentes: Marlan et al. 2003; IEA-OECD 2002.
EMISIONES ACTUALES POR REGIÓN
Para observar la contribución de los países a las emisiones en el año 2000, expresadas en términos de carbono, se ha tomado la distribución regional de los países, como se muestra en la gráfica 9. Esta distribución clasifica a los países en nueve regiones, las cuales en su conjunto emitieron 6,388 millones de toneladas de carbono.
GRÁFICA 9. CONTRIBUCIÓN PORCENTUAL DE LAS EMISIONES DE CARBONO POR REGIÓN EN EL AÑO 2000

Fuente: IEA-OECD 2002.
En las nueve regiones consideradas existen ciertos países que tienen mayor contribución; tal es el caso de Estados Unidos, que aporta 92.6% de la región de Norteamérica. En Asia, China aporta 92.6% de las emisiones de esta región y es el principal productor de carbón y cemento en el mundo. En Europa del Este influyen Rusia y Ucrania. En el Lejano Oriente 56.5% de las emisiones de la región son aportadas por la India y Corea del Sur, en tanto que Indonesia, Taiwán, Tailandia, Pakistán, Malasia, Singapur y Filipinas contribuyen con 40% (Marlan et.al. 2003).
En Europa Occidental dominan Alemania, Reino Unido, Italia, Francia y España, los cuales contribuyen con 74% de las emisiones de la región. Alemania es el segundo país importador de gas natural y el cuarto de crudo. En Oceanía, Japón y Australia contribuyen con 97% de las emisiones. Japón es el principal país importador de carbón y gas licuado en el mundo, el segundo de crudo y el tercero de gas natural.
En la región de Centro y Sudamérica, México y Brasil contribuyen con 51.6% de las emisiones; México contribuye con 98 de las 359 millones de toneladas de carbono que se emiten en la región. Otros países que emiten más de 10 millones de toneladas de carbono son: Venezuela (34.3), Argentina (37.6), Colombia (17.4) y Chile (17.1).
El índice de emisión promedio de la región es inferior a 0.75 toneladas de carbono por habitante por año, y de 1.1 toneladas por habitante por año para México y Chile, de 1.0 para Argentina, en tanto que para Brasil es de 0.5 toneladas de carbono por habitante por año (Marlan et al., 2003).
En Medio Oriente Arabia Saudita, Irán y Turquía, aportan el 62% de las 339 millones de toneladas de emisiones de carbono estimadas. En tanto que África está dominada por Sudáfrica, que contribuye con 42% de las emisiones, y otro 37% de las mismas es aportado por Egipto, Nigeria, Libia y Algeria. El índice de emisión promedio tiene un valor menor a 0.1 toneladas de carbono por habitante por año para 31 de las 54 naciones africanas, siendo superior en Libia con 2.26, Sudáfrica con 2.12, y Santa Elena con 1.17 (Marlan et al. 2003).
EMISIONES ACTUALES POR PAÍS
En la gráfica 10 se presentan los 15 países con mayores emisiones de carbono provenientes del uso de combustibles fósiles durante el año 2000. Como puede observarse, el orden de los países cambia en relación con su registro histórico, a excepción de Estados Unidos, que ocupa el primer lugar con 24.19% de las emisiones, seguido por China con 12.79%, Rusia con 6.43%, y Japón con 4.93% (IEA-OECD 2002).
También se puede observar que países como República Checa, Países Bajos y Bélgica ya no aparecen en esta segunda clasificación, como sucede en las emisiones históricas debido a que existen países como Corea del Sur y Brasil; cuyas emisiones actuales están por arriba de las emisiones de los tres primeros países mencionados.
GRÁFICA 10. EMISIONES DE CARBONO POR PAÍS EN 2000

PRINCIPALES FUENTES EMISORAS CONTAMINANTES
La utilización de combustibles fósiles es una de las principales fuentes de la contaminación atmosférica, tanto en procesos industriales, como en transportes o generación de calor. Además, algunos procesos diferentes de la combustión contribuyen considerablemente a las emisiones contaminantes.
Generalmente se suele distinguir la contaminación urbana de la industrial, siendo la primera la derivada del transporte, calefacciones y de establecimientos industriales de pequeño tamaño, mientras que por contaminación industrial se entiende la producida por procesos industriales de cierta entidad. Uno u otro tipo de contaminación son, en la práctica, difícilmente disociables.
Las principales fuentes artificiales emisoras de los diferentes contaminantes atmosféricos son las centrales térmicas, la industria petroquímica y química, la siderurgia y las industrias de sector metalúrgico en general, la industria alimentaria, papelera y del cemento, en lo que respecta al sector industrial; el transporte, las calefacciones de todo tipo en residencias, comercios, etc. y las instalaciones de incineración de basura doméstica y desechos industriales.
EL OZONO SU FORMACION EN LA ATMOSFERA COMO RESULTADO DE LA EMISION DE HIDROCARBUROS. SU EFECTO SOBRE LA SALUD.
La contaminación atmosférica puede afectar tanto a escala global (macroecológica) como local (microecológica), pudiéndose situar el origen de la misma en la acción del hombre (antropogénico) o simplemente en causas naturales (telúrico). Aunque se desconoce el total de contaminantes en la atmósfera y la forma que éstos tienen de actuar, un buen número de ellos están perfectamente identificados, así como la forma de interferir con el medio y los efectos que producen. La actividad contaminante introduce ciertos desequilirios en los ciclos biogeoquímicos (carbono, nitrógeno, oxígeno, azufre, fósforo, ...) lo que puede llegar a provocar reacciones de consecuencias inpredecibles para la Biosfera y, por tanto, para el conjunto de nuestro Planeta, amenazando un desarrollo sostenible que pueda garantizar la pervivencia, en condiciones adecuadas, a las generaciones futuras.
Las emisiones a la atmósfera tienen lugar en forma de gases, vapores, polvos y aerosoles así como de diversas formas de energía (contaminación térmica, radiactiva, fotoquímica, etc), quedando los contaminantes suspendidos en ella y produciendo la degradación del medio ambiente en su conjunto.
El control racional de la contaminación del aire tiene su primer antecedente en cuatro suposiciones básicas desarrolladas por la Asociación Americana para el Avance de la Ciencia (American Association for the Advancement of Science. Air Conservation. Washington, D.C., 1965.):

